隐睾
概述:隐睾系指一侧或双侧睾丸未能按照正常发育过程从腰部腹膜后下降至同侧阴囊内,又称睾丸下降不全,是小儿最常见的男性生殖系统先天性疾病之一。
 流行病学
流行病学
流行病学:隐睾在不同生长发育时期,其发病率呈逐渐下降趋势。据报道新生儿隐睾的发病率约占4%,
早产儿为30%,体重不足1800g的
早产儿高达60%~70%,1岁时降至0.6%~0.8%,青春期隐睾发病率约为1%,成年人为0.3%。表明在出生后睾丸仍可继续下降。据Scorer统计,出生后隐睾自行下降时间主要在生后3~6个月内,6个月后隐睾继续下降的机会明显减少。Kleinteich等统计一组3612小儿中28人(0.8%)在满1岁时仍有隐睾,这一数字与青春期隐睾发病率无明显差异,说明1岁以后隐睾几乎不会自行下降至阴囊。
隐睾发生率单侧多于双侧,约为5∶1,右侧隐睾占70%,左侧占30%。有遗传倾向,父子间发病率为1.5%~4%,兄弟间为6.2%。
 病因
病因
病因:由于胎儿期睾丸正常下降的机制尚不清楚,因此隐睾的病因学也有多种说法。
1.内分泌学说 有学者通过内分泌功能测定,认为隐睾可能是青春期前下丘脑-垂体-性腺轴功能失衡,黄体生成素(LH)-间质细胞(leydies cell)轴分泌不足,导致血浆睾酮降低,因为睾丸下降与睾酮水平密切相关,也有学者测定隐睾患者睾酮水平正常,提出主要是5α-还原酶缺乏,使双氢睾酮产生障碍,或是靶器官雄激素受体不足或受体基因突变等因素,妨碍睾酮与靶细胞受体蛋白结合。
某些垂体促性腺激素和雄激素紊乱疾病如Kallmann综合征(LH-RH不足),无脑畸形垂体发育不全等多伴有隐睾症,也表明垂体促性腺激素及雄激素之间与睾丸下降有一定关系。近来有人在隐睾患者血中发现抗促性腺激素细胞抗体,提出隐睾可能是患者垂体自身免疫性疾病。
2.解剖因素 主要有:①睾丸引带缺如:睾丸下降过程中,睾丸引带有牵拉作用,引带末端主要分支附着于阴囊底,睾丸随行引带的牵引而降入阴囊。②鞘状突未闭。③腹股沟部发育异常:内环过小或阴囊入口有机械性梗阻。④精索血管或输精管过短。
3.睾丸本身发育缺陷 有些病例存在睾丸本身的缺陷,如睾丸在宫内扭转后萎缩,仅存有精索血管和输精管残端,睾丸与附睾分离,附睾缺如等先天性缺陷影响睾丸下降(图1)。
 发病机制
发病机制
发病机制:隐睾常有不同程度的睾丸发育不全,体积较健侧明显缩小,质地松软,大部分病人伴有附睾、输精管发育异常,发生率约为19%~90%。约1%~3%的隐睾患者手术探查时睾丸已经缺如,仅见睾丸、附睾残迹和(或)精索血管、输精管残端。
隐睾的病理组织学特点为生殖细胞发育障碍,间质细胞数量减少。其改变随年龄增大而更加明显,成人隐睾曲细精管退行性变显著,几乎看不到正常精子。这些改变也和隐睾的位置有关,位置越低,越接近阴囊部位,病理损害就越轻微,反之病理损害越严重。
隐睾的病理组织学标志:①患儿1岁后仍持续出现生殖母细胞;②Ad型精原细胞数减少。正常睾丸曲细精管内生殖细胞的发育过程是:生殖母细胞→Ad型精原细胞→Ap型精原细胞→B型精原细胞→初级精母细胞→次级精原细胞→精子细胞→精子。正常男孩出生后60~90天血液中LH和FSH有一潮涌样分泌,刺激间质细胞增生,并分泌大量睾酮,形成睾酮峰波促使生殖母细胞发育成Ad型精原细胞。这一过程大约在出生后3~4个月时完成。由于隐睾患者生后60~90天的LH和FSH潮涌受挫,间质细胞数目减少,睾酮分泌量下降,不能形成睾酮峰波,从而使生殖母细胞转变成Ad型精原细胞发生障碍。
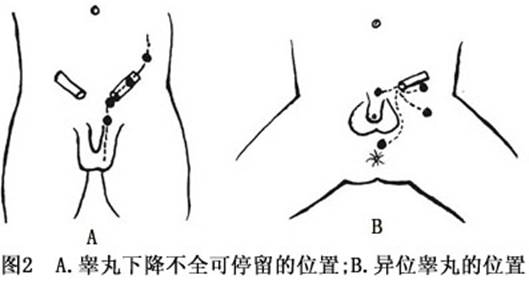
按睾丸所处位置,临床上将隐睾分为:①高位隐睾:指睾丸位于腹腔内或靠近腹股沟内环处,约占隐睾的14%~15%;②低位隐睾:指睾丸位于腹股沟管或外环处(图2)。
也有将隐睾分为4类:①腹腔内睾丸:睾丸位于内环上方;②腹股沟管内睾丸:睾丸位于内环和外环之间;③异位睾丸:睾丸偏离从腹腔至阴囊的正常下降路径;④回缩睾丸:睾丸可推挤或拉入阴囊内,松开后又缩上至腹股沟处。
 临床表现
临床表现
临床表现:没有并发症的隐睾患者一般无自觉症状。主要表现为患侧阴囊扁平,单侧者左、右侧阴囊不对称,双侧隐睾阴囊空虚、瘪陷。若并发腹股沟斜疝时,活动后患侧出现包块,伴胀痛不适,严重时可出现阵发性
腹痛、呕吐、发热。若隐睾发生扭转,如隐睾位于腹股沟管或外环处,则主要表现为局部疼痛性肿块,患侧阴囊内无正常睾丸,胃肠道症状较轻。如隐睾位于腹内,扭转后疼痛部位在下腹部靠近内环处,右侧腹内型隐睾扭转与
急性阑尾炎的症状和体征颇为相似,主要区别是腹内隐睾扭转压痛点偏低,靠近内环处。此外,患侧阴囊内无睾丸时应高度怀疑腹内
睾丸扭转。
 并发症
并发症
并发症:
1.生育能力下降或不育 隐睾的主要病理变化是生殖细胞发育障碍,因此可导致生育能力下降或不育。
Lipshultz(1976)报道一组在青春期前治疗的单侧隐睾病人,成年后约62%有生育能力,没有手术治疗者仅有40%~46%有生育能力。即使在青春期前治疗,其精液密度(2.68×104/ml)低,表明隐睾可以影响健侧睾丸的生育能力。Hecker对125例单侧隐睾病人做两侧睾丸活组织检查,健侧睾丸仅40%有正常成熟精子,并提出有可能存在自身抗体,但尚未被证实。单侧隐睾生育能力与手术年龄呈反比关系,即手术时年龄越大,术后生育能力越低。在1~2岁间手术者成年后生育率为87.5%,在3~4岁手术者为57%,如延迟到13岁以后则仅仅为14%。此外,单侧隐睾生育能力还受健侧睾丸与附睾的发育与成熟程度的影响,如附睾与睾丸附着变异,将阻碍成熟的精子向外输送而引起不育。
双侧隐睾患者生育能力显著下降,如睾丸位置较高,由于病理损害严重,生殖细胞发育严重障碍可致不育。但若隐睾位置较低,经适当治疗后,可望残留部分生育能力。
2.先天性腹股沟斜疝 隐睾者约65%伴有先天性腹股沟斜疝。这是腹膜腔与睾丸鞘膜腔之间的鞘突管未闭合,肠襻降入阴囊内的鞘突腔内所致。几乎所有隐睾腹膜腔与鞘突间的鞘突管未闭合,当鞘状管口狭小时则不形成疝,有些患儿在生后几个月即发生较大疝,可压迫精索血管,使隐睾进一步萎缩,有些则发生斜疝嵌顿和绞窄,这些均须尽早采取手术治疗。一般情况下则待患儿稍大后与隐睾一并手术处理。
3.隐睾扭转 Wallenstein统计150例
睾丸扭转病人中,有90例(60%)为隐睾患者。未降睾丸发生扭转的机会是阴囊内睾丸的21~53倍。其发病原因和机制不明,可能与睾丸引带或提睾肌附着异常有关。
4.隐睾损伤 由于隐睾常位于腹股沟管内或耻骨结节附近,位置比较表浅、固定,容易受外界暴力创伤。随着年龄增长,隐睾患者活动范围增大,创伤机会也随之增多。伤后睾丸易发生纤维变性,加速其萎缩。
5.隐睾恶变 隐睾患者发生睾丸肿瘤的机会,比正常睾丸大20~40倍。高位隐睾,特别是腹内型隐睾,其恶变发生率比低位隐睾约高4~6倍。腹内型隐睾其睾丸肿瘤发生率为22.7%,Campbell的统计其恶变率高达48.5%,而腹股沟或外环处隐睾仅为6.8%。据临床观察,10岁以后手术者不能防止肿瘤发生,10岁以前手术可明显减少肿瘤的发生,3岁前手术则能避免肿瘤的发生。一般认为睾丸固定手术并不能预防恶性变的发生,即使早期手术,也不会逆转这种恶变倾向。但下降至阴囊的睾丸发生恶变后容易被早期发现。
隐睾恶变的发病年龄多在30岁之后。其发病原因除睾丸自身因素外,还与局部温度、血运障碍、内分泌功能失调等有关。Sohval观察隐睾中的未分化曲细精管和阴囊内睾丸发生精原细胞瘤的变化相似,认为隐睾中先天性缺陷是使其更易发生恶变的原因。Batata等统计137例隐睾伴发恶变的资料,93例已行睾丸固定术,44例未手术。手术组年龄12岁,发生肿瘤平均年龄32岁,间隔平均时间20年。未手术组发病平均年龄也是32岁,认为隐睾纠正后应至少严密观察20年。
 实验室检查
实验室检查
实验室检查:双侧不能扪及的隐睾患者,术前应行性激素试验。试验前先测定血清
睾酮、黄体生成激素(LH)和卵泡激素FSH值,然后肌内注射HCG绒毛膜促性腺激素1000~1500U,隔天1次,共3次后复查
睾酮、LH和FSH值。若
睾酮值升高或对HCG无反应,但LH和FSH不增高,则说明至少存在一个睾丸,应进行手术探查。若试验前LH和FSH已增高,注射HCG后
睾酮值不升高,则可诊断为双侧睾丸缺如,毋需手术探查。
 其他辅助检查
其他辅助检查
其他辅助检查:对于不能扪及的隐睾,术前可通过一些特殊检查来判断是否存在睾丸及隐睾所处的位置。如疝囊造影,睾丸动脉、静脉造影,这些检查操作复杂,成功率较低,且有一些副损伤和并发症,检查结果也不容易明确,现已很少应用。无损伤性检查,如B超除对腹股沟管内隐睾可准确定位外,对腹内隐睾的诊断无任何价值。CT、MRI检查价格昂贵、特异性差,也只能作为参考。近年腹腔镜用于不能触及的隐睾的术前检查,取得了较满意的效果(具体方法见后)。另外一种较理想的睾丸定位方法是用核素标志的HCG放射性核素扫描,应用核素标志的HCG,使睾丸的LH/HCG受体上聚集足够数量的HCG,从而在γ照相扫描中显示睾丸。
 诊断
诊断
诊断:查体时,应首先在病人立位检查睾丸。如果触诊不满意,还应再取仰卧位检查。应该避免室内过冷,并避免引起提睾反射的刺激。因为这些因素可能诱发提睾反射和睾丸的回缩。有些时候体检前洗个温水浴更有利于检查。大约20%隐睾在体检时不能被扪及,这并不意味着这些隐睾都位于腹腔内。不能扪及的隐睾在手术中,约80%可在腹股沟管内或内环附近被发现,在剩余的20%中,单侧睾丸缺如约占3%~5%,双侧睾丸缺如约占0.6%。手术探查时,约65%睾丸缺如者可在腹股沟内环处找到精索和输精管残端。这样需要进行腹内探查寻找睾丸的病例仅占全部隐睾的2%~3%。
 鉴别诊断
鉴别诊断
鉴别诊断:应与睾丸缺如、异位睾丸、回缩性睾丸等相鉴别。
回缩性睾丸多见于婴幼儿,是由于提睾肌过度收缩所致,随着年龄增长,睾丸增大和提睾肌作用减弱,这种现象将逐渐减少。回缩睾丸用手轻柔地向下推挤,可回纳至阴囊内,松手后睾丸可在阴囊内停留一段时间。与滑动睾丸的区别是后者被推进阴囊后,一旦松手睾丸即退回原来位置,属隐睾范畴。
异位睾丸可在耻骨联合上方、股部或会阴部找到睾丸。正常睾丸下降时,绝大多数情况下,沿着引带末端的阴囊分支而进入阴囊底部,如睾丸未降至阴囊底部,而沿睾丸引带末端的其他分支下降至耻骨部、股部或会阴部,则形成异位睾丸。约占隐睾的1%。
 治疗
治疗
治疗:无论是单侧或双侧隐睾,在病理上都存在着退行性变,且随年龄增大而加重,因此隐睾确诊后,如生后1年仍不下降,即开始治疗。
1.激素治疗 隐睾尤其是双侧隐睾的病因可能与内分泌有关,因此1岁后可给予内分泌治疗,目前应用的内分泌有:
(1)绒促性素(HCG):治疗目的是改善间质细胞(leydig’s cell)和支持细胞(Sertoli cell)功能,促进睾丸发育,增加
睾酮分泌,促使睾丸下降。有效率约为14%~50%,剂量为1000~1500U,隔天肌内注射,1个月后随访。总量应>1万U,2万U并不增加疗效,相反会有促使睾丸萎缩的不良反应。
(2)黄体生成素释放激素(LH-RH):有效率为30%~40%,剂量为1.2mg/d。每侧鼻孔200µg,3次/d,经鼻雾化吸入,4周为1疗程,3个月后随访。
(3)LH-RH HCG:两者联合应用,可提高疗效,剂量LH-RH 1.2mg/d,分3次经鼻雾化吸入,持续4周后 HCG 1000~1500U,每周1次,共用3周。
2.手术治疗 睾丸固定术是治疗隐睾的主要方法,初诊时已超过6个月或激素治疗无效,1岁以后即可行手术治疗,采用腹股沟部斜切口的睾丸肉膜囊外固定已被国内外广泛应用,对精索血管过短的隐睾可分两期手术,以充分保证睾丸的血供,但也有第2次手术误伤精索血管的可能,对长襻输精管高位隐睾可应用Fowler-Stephens术式,近来推荐此术式的改良方法,Fowler-Stephens分期手术,即初期手术仅高位切断精索血管蒂,不作睾丸固定,第2期有待丰富侧支循环建立后,将睾丸固定于阴囊内,减少了睾丸萎缩的机会。
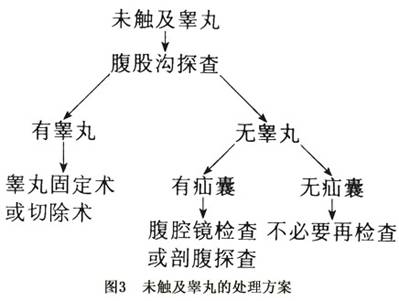
3.未触及睾丸的处理 经2名有经验的泌尿科医师对患者经卧位、立位仔细检查,未能触及睾丸者称未触及睾,约85%以上位于腹股沟部位,Hali等对161个未触及睾丸者行腹股沟探查,仅6个未找到睾丸,其中5个不伴有疝囊,进一步作腹腔镜及腹内探查,证实为睾丸缺如,1例同侧有疝囊,于腹腔内找到睾丸,表明隐睾患者睾丸有无与疝囊有密切关系,因此Hali提出对体检、影像学及激素激发试验等项检查未扪及的睾丸,治疗方法当以腹股沟探查为首选,如腹股沟有疝囊、无睾丸,应进一步作腹腔镜或剖腹探查,如同侧无疝囊亦无睾丸,可诊断为睾丸缺如,没有必要进一步探查。如腹腔镜发现内环处有血管索状物,表明腹腔内可能有睾丸残余结节存在,应予切除,具体方案见图3。
腹腔镜在隐睾诊断与治疗中的应用:1901年,Kelling应用膀胱镜经人工造口进入狗的腹腔,通过过滤的空气造成气腹进行腹腔检查,首次提出了腹腔镜概念。至1910年Jacobaeus才将这一技术应用于临床。此后,许多学者在设备、技术等方面进行了大量探索和改进。1924年Zollikofer改用CO2作气腹;1929年Kalk设计出135°镜及气腹针;1938年Veress制成弹簧气腹针,此针沿用至今并以他命名,即Veress气腹针。1960年Semm发明了自动气腹机,同年Hopkins改进了冷光源导光系统,使腹腔镜也可方便应用冷光源;1996年Hopkins又设计出柱状石英腹腔镜。此改进对现代腹腔镜的广泛应用,起到了积极推动作用。
1976年Cortesi等在泌尿外科首次应用腹腔镜对隐睾进行了定位和活检,成为目前腹内隐睾和睾丸缺如的一种安全、准确的诊断方法。据1974年美国泌尿外科协会(AUA)统计,隐睾占整个泌尿外科腹腔镜手术的11%,平均手术时间14min,准确率达98%,并发症仅为1.6%。腹腔镜不仅能对隐睾进行定位和评估,而且还能进行腹内隐睾固定或切除术。自1982年Scott及Cohen首次应用腹腔镜治疗高位隐睾以来,已有较多应用腹腔镜治疗隐睾的报道,并逐渐受到泌尿外科医生的重视。
 预后
预后
预后:目前暂无相关资料
 预防
预防
预防:目前暂无相关资料



 流行病学
流行病学
 病因
病因
 发病机制
发病机制
 临床表现
临床表现
 并发症
并发症
 实验室检查
实验室检查
 其他辅助检查
其他辅助检查
 诊断
诊断
 鉴别诊断
鉴别诊断
 治疗
治疗
 预后
预后
 预防
预防